Table of Contents
Le produit ionique de l’eau :
L’autoprotolyse de l’eau
On dit que l’eau pure est neutre c’est à dire qu’il constitue seulement de molécules d’eau H2O.
La mesure de conductivité et le pH de l’eau pure à la température 𝟐𝟓℃ donne les valeurs :
𝝈 = 𝟓, 𝟓. 𝟏𝟎−𝟔 𝑺. 𝒎−𝟏 et pH = 𝟕, 𝟎
Ces valeurs montrent une conductivité dans l’eau pure donc l’existence des ions
Les ions trouvés :
- des ions H3O+ (ion hydronium ou oxonium)
- des ions OH– (ion hydroxyde)
Ces ions ne peuvent provenir que d’une réaction spontanée (se produit sans intervention extérieure) entre 2 molécules d’eau.
Puisque l’eau est un ampholyte, donc il joue le rôle d’un acide et d’une base respectivement dans les couples (H3O+ / H2O) et (H2O / OH–)
Il s’agit de la réaction :
H2O(ℓ) + H2O(ℓ) <=> H3O+(aq) + HO–(aq)
C’est une transformation limitée appelée « autoprotolyse de l’eau »,
Le pH de l’eau pure à 25°C est 7,0 , on a donc
[H3O+]= 1,0.10-pH =1,0.10-7 mol.L-1
Dans l’eau pure il y a nécessairement autant de H3O+ que de OH– donc
[H3O+] = [OH–]
A 25°C, dans l’eau pure : pH = 7,0 et [HO–] = [H3O+] = 10-pH = 1,0.10-7 mol.L-1
Application
- On détermine à 25°C pour V= 1,0 L d’eau l’avancement à l’équilibre et l’avancement maximal de la réaction autoprotolyse de l’eau .
- Déduire le taux d’avancement final de cette réaction.
On donne (𝒆𝒂𝒖) = 𝟏 𝒈. 𝒄𝒎−𝟑.
Quantité de matière initiale n :pour 1 litre d’eau :
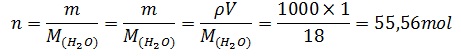
Posons n0=1/2 n = 27,78 mol pour 1/2 litre
Le tableau d’avancement de la réaction :

D’après le tableau d’avancement :

L’avancement maximal :
n0 Déjà calculé n0=1/2 n = 27,78 mol

Le taux d’avancement final

La réaction d’autoprotolyse de l’eau est une transformation très limitée.
Produit ionique de l’eau
Définition : Le produit ionique de l’eau est la constante d’équilibre associée à l’équation d’autoprotolyse de l’eau.
H2O + H2O = H3O+ + HO–
Cette constante est notée Ke : Ke = [H3O+ ]eq . [OH– ]eq Ke s’exprime sans unité
Pour toute solution aqueuse à 25°C, Ke=1,0.10-14 =[H3O+].[HO–].
On note pKe = – log Ke donc pKe = 14 à 25°C
Utilisation de Ke pour calculer la concentration en ion hydroxyde :
La réaction d’autoprotolyse de l’eau a lieu dans toutes les solutions aqueuses. On peut donc utiliser l’expression du produit ionique de l’eau pour calculer la concentration en ions hydroxyde :

Solutions neutres, acides, basiques
Le caractère acide, basique ou neutre de la solution est définit en comparant le pH de cette solution au pH de l’eau pure à la même température
La solution est neutre dans le cas:
[H3O+ ] = [HO – ]Ke = [H3O+ ] . [OH– ] =[H3O+]2
log Ke = – log ( [H3O+]2 ) = -2 log [H3O+]
donc pH = 1/2 pKe A 25°C on a pH = 7
La solution est acide dans le cas : [H3O+ ] > [HO – ]
[H3O+]2 >Ke <=> – log ( [H3O+]2 = -2 log [H3O+] < – log Ke
donc pH <1/2pKe A 25°C on a pH < 7
La solution est basique dans le cas : [H3O+ ] < [HO – ]
[H3O+]2 <Ke <=> – log ( [H3O+]2 = -2 log [H3O+] > – log Ke
donc pH >1/2 pKe A 25°C on a pH > 7
Ci-dessous Les différentes situations possibles sur l’échelle de pH donnée :

Constante d’acidité du couple 𝒂𝒄𝒊𝒅𝒆/𝒃𝒂𝒔𝒆
Définition
La constante d’acidité KA du couple AH/A– est la constante d’équilibre associée à la réaction de l’acide AH sur l’eau d’équation :
AH(aq) + H2O (l) <=> A– (aq) + H3O+(aq).
L’expression de la constante d’acidité est :
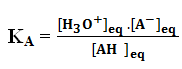
Les concentrations des espèces sont à l’équilibre, exprimées en mol.L-1.
KA est sans dimension.
Chaque couple acide/ base possède une constante d’acidité qui lui est propre et dont la valeur ne dépend que de la température.
On définit aussi le pKA d’un couple acide-base : pKA = – log KA et KA = 10 – pKA
Relation entre le 𝒑𝑯 et la constante d’acidité 𝑲𝑨

Constante d’acidité des couples de l’eau
L’eau fait partie de deux couples acido-basiques : H2O / HO– et H3O+ / H2O
1er couple : H2O / HO– l’eau est l’acide du couple
Equation de la réaction avec l’eau: H2O + H2O <=> H3O+ + HO– autoprotolyse de l’eau
KA1 = [H3O+].[HO–] KA1 = Ke = 1,0.10-14 et pKA1 = pKe = 14
2ème couple : H3O+ / H2O l’eau est la base du couple.
équation de la réaction avec l’eau : H2O + H3O+<=> H3O+ + H2O
KA2 = [H3O+] / [H3O+] KA2 = 1 et pKA2 = 0
L’eau se comporte comme une base et comme un acide, c’est un ampholyte (ou amphotère).
Constante d’équilibre associée à une réaction acido-basique
Une réaction acido-basique est un transfert de proton entre l’acide A1H d’un couple A1H/A1– et la base A2– d’un couple A2H/A2–.
L’équation de la réaction est la suivante : A1H + A2– <=>A1– + A2H
La constante d’équilibre associée à l’équation de la réaction est :
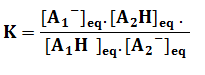
Multiplier par [H3O+]eq le numérateur et le dénominateur de l’expression de K

Donc la constante d’équilibre de la réaction acido-basique est : K = 10 (pKA2 – pKA1)
Force d’un acide et force d’une base
Comparaison du comportement d’acides en solution
On prépare à 25° C deux solutions acides S1 acide éthanoïque et S1 d’acide benzoïque de même concentration C= 10-2 mol.L-1
| Solutions acides | KA | pH |
| (S1) | 1,6.10-5 | 3,4 |
| (S2) | 6,3.10-5 | 3,1 |
L’équation de la réaction de l’acide HA avec l’eau
HA(aq) + H2O(ℓ) <=> A– (aq) + H3O+ (aq)
On cherche l’expression du taux d’avancement final 𝛕 de cette réaction en fonction du pH et C

On calcule pKA et 𝛕 de S1 et S2
| Solutions acides | pH | pKA | 𝛕 |
| (S1) | 3,4 | 4,8 | 4% |
| (S2) | 3,1 | 4,2 | 8% |
Comment varie 𝛕 en fonction pH ?
Pour les solutions acides de même concentration, Plus 𝛕 est grand plus le pH de la solution est faible.
Exprimer la constante d’acidité KA en fonction du taux d’avancement final t de la réaction de l’acide avec l’eau. ?
Le tableau d’avancement de la réaction entre l’acide HA et l’eau :


KA est une fonction croissante de 𝛕
Ainsi, pour les solutions acides de même concentration, 𝛕 est d’autant plus élevé que le KA est grande.
Conclusion
Pour les solutions aqueuses acides de même concentration, plus la constante d’équilibre KA est grande (pKA est petite), plus le pH est faible et plus le taux d’avancement final t est élevé.
Comparaison du comportement des bases dans une solution aqueuse
On prépare, à 25° C , deux solutions S1 d’ammoniac et S2 de méthylamine de même concentration C= 10-2 mol.L-1
| Solutions basique | KA | pH |
| (S1) | 6,3.10-10 | 10,6 |
| (S2) | 2.10-11 | 11,4 |
L’équation de la réaction de la base B avec l’eau
B(aq) + H2O(ℓ) <=> BH+ (aq) + OH– (aq)
On cherche l’expression du taux d’avancement final 𝛕 de cette réaction en fonction du pH et C

On Calculer t et pKA des solutions S1 et S2
| Solutions basique | pH | pKA | t |
| (S1) | 10,6 | 9,2 | 4% |
| (S2) | 11,4 | 10,7 | 25% |
Comment varie 𝛕 en fonction pH ?
Pour les solutions basiques de même concentration, 𝛕 est d’autant plus élevé que le pH de la solution est grand.
Exprimer la constante d’acidité KA en fonction du taux d’avancement final 𝛕 de la réaction de la base B avec l’eau. ?
Le tableau d’avancement de la réaction entre la base B et l’eau :

Donc pour les solutions basiques de même concentration, 𝛕 est d’autant plus élevé que le KA est faible.
Conclusion
Pour les solutions aqueuses basiques de même concentration, plus la constante d’équilibre KA est petite (pKA est grande), plus le pH est grand et plus le taux d’avancement final t est élevé
Diagramme de prédominance et de distribution
Diagramme de prédominance
On utilise la relation déjà vu

Diagramme de distribution
On appelle le diagramme de distribution de l’acide et sa base conjuguée du couple AH/ A–
Les deux graphes qui représentent l’évolution des pourcentages de l’acide AH et la base A– en fonction du pH, tel que


A l’intersection des deux graphes on a :
α(AH)= α(A–) =50% d’où [AH] = [A–] donc pH = pKA
Cas des indicateurs colorés
Un indicateur coloré acido-basique est un couple acide / base noté HIn/ In– dont la forme acide HIn et la forme basique In– ont des couleurs différentes en solution

Zone de virage
La zone de virage est l’intervalle pKA-1 < pH < pKA+1, , dans laquelle les concentrations des deux espèces acide et basique sont voisines, alors la solution prend une couleur qui est un mélange des deux couleurs de HIn et In– : on appelle cette couleur la teinte sensible








